- PDF:PDF版をダウンロード
- DOI: https://doi.org/10.15108/stih.00196
- 公開日: 2019.12.20
- 著者: 伊藤 裕子
- 雑誌情報: STI Horizon, Vol.5, No.4
- 発行者: 文部科学省科学技術・学術政策研究所 (NISTEP)
ほらいずん
新しい創薬モダリティとしての核酸医薬の動向
核酸医薬とは核酸から成る薬で、アンチセンス、アダプター、siRNAなどの種類がある。近年、核酸医薬は新しい創薬モダリティ(創薬技術の方法・手段)として注目されるようになった。これまでに市場に出た核酸医薬は米国で8品であり、そのうち5品が2016年以降に出ている。核酸医薬は、疎水性が高く細胞内に取り込まれにくい上に生体内の酵素で分解を受けやすいので、標的まで薬を送達するためのDDS技術や核酸構造の安定化の技術が重要である。この点の改善により、核酸医薬の市場化が加速している。現状では、薬の適応は主に遺伝性の希少疾患であるが、将来的にはがんなどの治療薬として市場に出ることが期待される。
キーワード:核酸医薬,創薬モダリティ,市場化,DDS技術,siRNA
1.はじめに
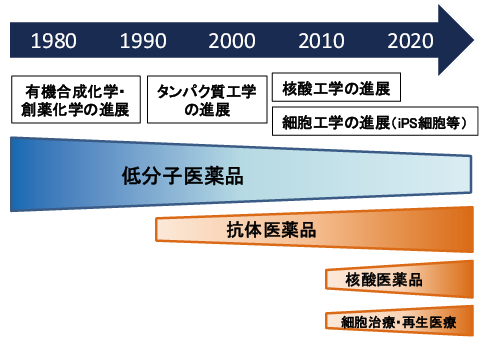
近年、「創薬モダリティ」という言葉が、製薬企業や創薬研究を実施する公的研究機関などを中心に広く使われるようになってきた。モダリティ(modality)は、様相や様態といった意味である。創薬モダリティとは、創薬技術の方法・手段を包括したカテゴリーを指す際に使われる1)。
20世紀後半からライフサイエンス分野の研究は飛躍的に進展し、それにより創薬技術が発展した。タンパク質や抗体あるいは遺伝子や細胞など、これまで薬として用いられてこなかった様々な物質が医薬品として用いられるようになり、結果として創薬モダリティは多様化した。いわば、創薬研究は、新たな創薬モダリティの探索の繰り返しといえる。
現在、既存の創薬モダリティとしては低分子医薬や抗体医薬等、新しい創薬モダリティとしては核酸医薬及び患者自身の免疫細胞を利用する免疫細胞治療(CAR-T療法:2017年米国、2019年日本で承認)や再生医療などが含まれる2、3)(図表1)。
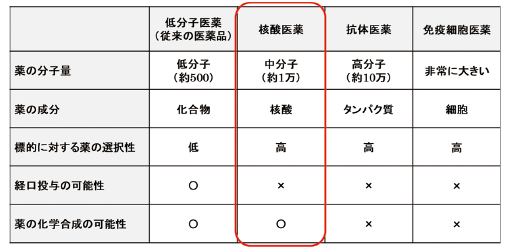
図表2に主な創薬モダリティごとの特徴を示した。核酸医薬は、分子量はかなり大きいが、低分子医薬のように化学合成で薬をつくることができ、抗体医薬や免疫細胞医薬のように薬の標的に作用する選択性が高いといった、他の創薬モダリティと比較して中間的な特徴を持つ。
本稿では、核酸医薬の現状について概説し、今後の動向の予測についても言及する。
2.核酸医薬の現状
(1)これまでに市場に出た核酸医薬
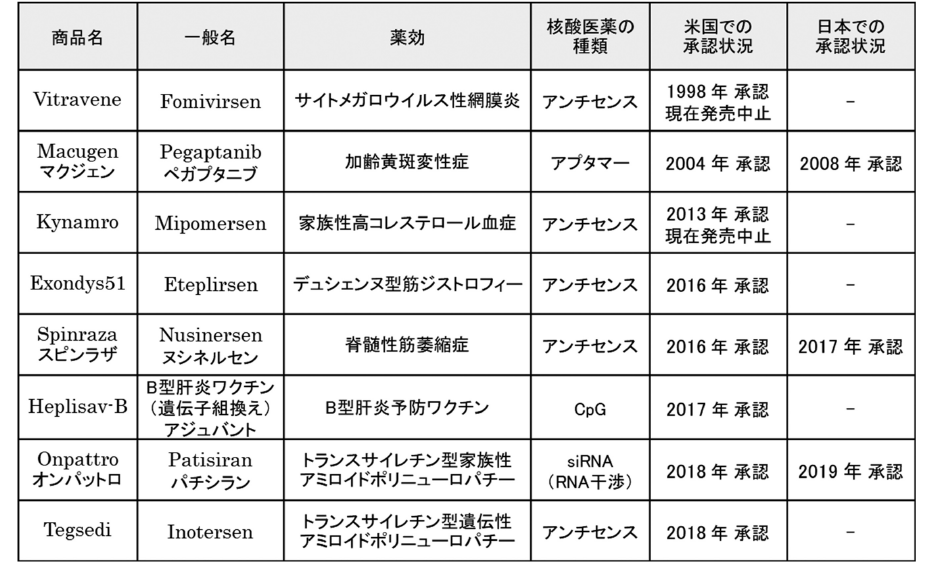
これまでに、医薬品承認されて市場に出た核酸医薬は8品(2019年10月1日現在)で、すべて米国発であり、うち3品が日本でも承認されている(図表3)。
最初の核酸医薬Vitraveneは1998年に米国で承認され市場に出たが、次のMacugenが出るまでに6年かかり、その次のKynamroは更に9年を要した。ところが、2016年にExondys51及びSpinrazaが承認されて以降、これまでのブランクを埋めるように、毎年、新しい核酸医薬が市場に出ている。
核酸医薬は、20塩基程度の短いオリゴヌクレオチド核酸から構成される薬の総称であり、薬の標的や作用の異なる様々な種類の核酸医薬が開発されている。現在、市場化されている核酸医薬の種類には、細胞内の標的遺伝子のmRNAを分解・阻害あるいは変化させるもの(アンチセンス及びsiRNA)、細胞外の標的タンパク質の機能を阻害するもの(アプタマー)、細胞表層のタンパク質に作用して免疫を活性化するもの(CpG)がある4)。
投与方法も多様であり、VitraveneとMacugenが眼球の硝子体内、KynamroとTegsediが皮下、Exondys51とOnpattroが静脈内、Spinrazaが髄腔内、Heplisav-Bが筋肉内に投与する4)。眼球の硝子体内及び髄腔内への投与は局所投与であり、それ以外の皮下・静脈内・筋肉内への投与は全身性の作用を期待しているので全身投与である。
(2)ノーベル賞の成果を利用した核酸医薬siRNA
2018年8月に米国で承認(日本では2019年6月)のOnpattroオンパットロは、2006年のノーベル生理学・医学賞のRNA干渉(特異的な2本鎖RNAで標的のmRNAを破壊できること)を利用した核酸医薬(siRNA)である。アンチセンスの核酸医薬よりも、siRNAの核酸医薬は活性が極めて高いといわれる5)。
RNA干渉の発見の論文は1998年に発表されたので、基礎研究から約20年、ノーベル賞受賞から12年で医薬品の市場化に到達したことになる。しかし、医薬品開発の道のりは平たんではなく、2010年には大手製薬企業がsiRNA薬の開発から相次いで撤退したという6)。
核酸医薬は疎水性の高い高分子であることから細胞内へ取り込まれにくい性質を持つ。2本鎖のsiRNAは、1本鎖のアンチセンスの核酸医薬に比べて分子量が2倍になることから、この点の性質が強まり、医薬品実現の障壁がより高くなる6)。
(3)核酸医薬の開発のブレイクスルーポイント
① 核酸医薬を安定して運ぶ技術
siRNAの細胞内への取り込みを改善する最も重要な技術は、DDS(ドラッグデリバリーシステム)技術である。siRNAに用いられる代表的なDDS技術には、siRNAを脂質で封入したナノ粒子である“LNP(lipid nanoparticle)”と、核酸送達に適したリガンドとsiRNAとの共有結合体の“コンジュゲート”があり、オンパットロにはLNPが使われた6)。LNPの開発は、オンパットロの開発者である米国のAlnylam Pharmaceuticals社が牽引したという7)。
LNPは、血中でApoE(脂質代謝やコレステロール輸送に重要な役割を担うリポタンパク質)と結合し、ApoEの受容体を高発現する肝実質細胞(肝機能を担う細胞)内に効率よく取り込まれて、標的遺伝子に作用する7)。オンパットロは、肝臓で標的のトランスサイレチン変異遺伝子に作用して、トランスサイレチン変異タンパク質の生産を阻害することで、ポリニューロパチー(多発神経障害)患者の症状の改善といった治療効果を上げる。
一方、コンジュゲートを利用したsiRNAは、まだ市場に出ていない(2019年10月1日現在)。しかし、臨床試験(治験)段階では、コンジュゲートを利用したsiRNAは少なくない。2018年8月の時点で、臨床試験において多く使用されているコンジュゲートは、GalNacコンジュゲートである6)。これは肝実質細胞に特異的に高発現するアシアロ糖タンパク質受容体のリガンドである単糖のGalNAcとsiRNAを結合したもので、皮下投与により肝実質細胞へ高効率に移行し、標的遺伝子に作用できる7)。
LNPとGalNacコンジュゲートのどちらも、肝臓の細胞に取り込まれることが特徴である。大きな違いは、GalNacコンジュゲートはより簡便な皮下投与が使えるが、LNPはできない(静脈内投与)という点である。
② 核酸医薬自体を安定化する技術
核酸医薬が生体内で効果を発揮するためには、生体内に存在する核酸分解酵素(ヌクレアーゼ)に対する抵抗性や標的との結合安定性の強化が必須である。そのために、核酸の構造の一部を化学修飾している。核酸の化学構造は“核酸塩基-糖部-リン酸基”を構成単位(これをヌクレオチドと呼ぶ)とし、リン酸基を介して次のヌクレオチドと結合している。
アンチセンスの核酸医薬であるKynamro及びSpinrazaでは、リン酸基がホスホロチオエート結合に、糖部が2’-MOEに化学修飾され、その結果、核酸分解酵素に対する耐性と標的RNAに対する結合性の向上を得た8)。一方、Exondys51では、リン酸基がホスホロジアミデート結合に化学修飾され、糖部がモルフォリン骨格のモルフォリノ核酸に改変されたことで、天然の核酸とは大きく構造が異なり、生体内での安定性が大幅に向上した8)。
3.核酸医薬の将来予測
(1)日本において、次に市場に出る可能性が高い核酸医薬
厚生労働省には「先駆け審査指定制度」があり、これは、「患者に世界で最先端の治療薬を最も早く提供することを目指し、一定の要件を満たす画期的な新薬等について、開発の比較的早期の段階から先駆け審査指定制度の対象品目に指定し、薬事承認に係る相談・審査における優先的な取扱いの対象とする」9)ものである。
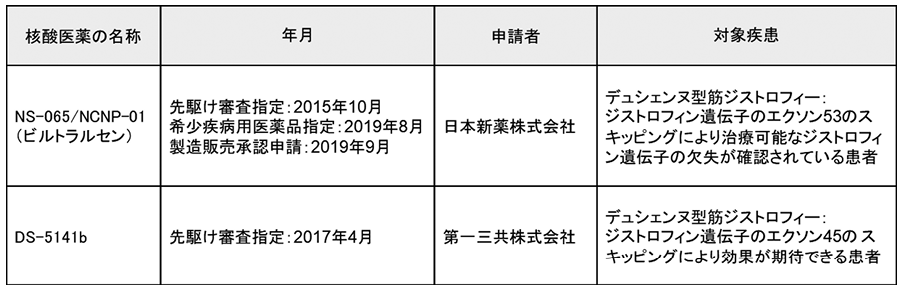
先駆け審査指定制度の対象品目一覧表は独立行政法人医薬品医療機器総合機構のウェブに公開されている。2019年9月19日現在、医薬品の21品目のうち、2品目が核酸医薬である10)(図表4)。いずれも、デュシェンヌ型筋ジストロフィーに対する治療を目的とした核酸医薬である。標的とするジストロフィン遺伝子の変異部分を核酸医薬が作用してスキップし、正常なジストロフィンタンパク質のみをつくらせることで治療効果を期待する。
ビルトラルセンが先駆け審査の対象品目に指定されたのは2015年であり、2019年8月には希少疾病用医薬品の指定(助成金、指導・助言、税制控除といった支援措置を受けられる)がされた11)。さらに、日本新薬株式会社は2019年9月26日付のニュースリリースにおいて、厚生労働省にビルトラルセンの製造販売の承認申請をしたこと、米国FDAにも段階的に承認申請を実施していることを発表した12)。したがって、日米どちらにしても市場化は近い可能性がある。
なお、ビルトラルセンは、国立研究開発法人国立精神・神経医療研究センターと日本新薬株式会社との共同研究を通じて開発された、アンチセンスの核酸医薬であり、Exondys51と同様にモルフォリノ核酸が用いられている13)。
ビルトラルセンが承認されれば、初の日本発の核酸医薬となる。
(2)科学技術予測調査で示唆される核酸医薬の今後
文部科学省科学技術・学術政策研究所(NISTEP)では、科学技術の広範な分野を対象として、中長期的な発展の方向性について専門家の知見を得ることを目的として、専門家を対象にした大規模な科学技術予測調査(以下、科技予測調査)を約5年ごとに実施している14)。調査の予測期間(将来を展望する期間)は、各調査実施年からおおよそ30年間とし、この期間に実現が期待される科学技術を“科学技術トピック”として調査の対象としている。
図表5に示すように、日本を含む世界のどこかで科学技術的に実現する時期を“科学技術的実現予測年”とし、日本で社会的に実現する(実現した科学技術が製品やサービス等として利用可能な状況となる)時期を“社会的実現予測年”とした。科学技術トピックに核酸医薬が初めて登場したのは第8回科技予測調査(調査実施:2005年)であり、「創薬に向けて、siRNAなどを用いて個体レベルで遺伝子発現を直接制御する技術」の科学技術的実現予測年は2014年、社会的実現予測年は2026年となった。
しかし、実際には家族性高コレステロール血症を対象としたKynamroが2013年に米国で承認され、脊髄性筋萎縮症に対する治療薬であるSpinrazaが米国で2016年、日本で2017年に承認されているように、科技予測調査の結果よりも早く(社会的実現予測年よりも10年前倒しで)、社会的に実現している。
第9回科技予測調査の科学技術トピック「siRNAなどの核酸医薬の全身投与による疾病治療」についても、2013年米国承認のKynamroが皮下投与、2018年に米国、2019年に日本で承認のオンパットロが静脈内投与といった全身投与であるので、これも社会的実現予測年よりも11年早い実現である。
第10回科技予測調査の「全身投与で肝臓以外の疾病も治療が可能な、siRNA、アンチセンスなどの核酸医薬」についても、オンパットロが社会的実現の事例として示すことができる。社会的実現予測年よりも、6年早い実現である。
第11回科技予測調査の「目的とする組織・器官への送達と細胞内DDS技術を実現させる核酸医薬品」は、今後、核酸医薬が発展するためにキーとなる技術であり、まだ実現していない。調査では、社会的実現予測年は2030年とされたが、これまでの予測結果から予想すると、もっと早く、2025年頃には社会的に実現する(市場に出てくる)と考えられる。
また、図表5に示すように、科学技術的実現予測年と社会的実現予測年との差が、第8回科技予測調査では12年、第9回科技予測調査では10年、第10回科技予測調査では5年、第11回科技予測調査では2年と、ここ15年間で急速に短縮している。これは、科学技術的に実現した成果が速やかに社会的に実現(市場化)する流れが加速していると、調査回答者が認識しているようにみえる。
事実、先駆け審査指定制度の戦略である「先駆けパッケージ戦略~革新的医薬品等の実用化促進~」が発表されたのは2014年で、先駆け審査指定制度の試行が開始されたのが2015年である9)。2015年実施の第10回科技予測調査の結果から、顕著に科学技術的実現予測年と社会的実現予測年との差が短縮しているということは、回答者が近年の新薬開発や承認に対する優先的な制度の整備状況を踏まえて回答したことが反映している可能性がある。
別の可能性として、イノベーションモデルの変化が考えられる。イノベーションのリニアモデルは、研究→開発→製造→販売(市場化)と、段階的で直線的な時間経過をたどるモデルであり、創薬はリニアモデルがあてはまるとされてきた。しかし、科学技術的実現予測年と社会的実現予測年との差が短くなっていることは、近年の創薬がリニアモデルから非直線的なモデルに変化していることを示唆すると考えられる。

4.まとめ
現在の核酸医薬の治療対象の多くは、遺伝性の変異を伴う希少疾患である。しかし、DDS技術などの進展により、目的とする組織・器官へ自由にかつ安定的に核酸医薬を送達することが可能になれば、治療対象の疾患が急速に広がると考えられる。
実際に、基礎研究段階ではあるが、抗がん作用を持つ、様々なsiRNAや次の核酸医薬として長い間にわたって期待され続けているmiRNA(マイクロRNA)15)の研究開発が進行している4、6)。したがって、近い将来に、がん治療薬としての核酸医薬が市場に出てくると考える。
参考文献・資料
1) Valeur, E., et.al., New Modalities for Challenging Targets in Drug Discovery, Angewandte Chemie International Edition, Vol.56(35):10294-10323, 2017.
2) 科学技術振興機構 研究開発戦略センター「俯瞰ワークショップ報告書 次世代医薬・基盤技術の動向と展望、推進すべき研究開発戦略」、2018.
3) 戸邊雅則、「創薬化学の側面から見た低分子医薬の将来像-低分子から中分子への広がり-」、医薬産業政策研究所リサーチペーパー・シリーズNo.72、2018年5月
4) 今野雅允、石井秀始、「核酸医学によるがん治療の最前線」、医学のあゆみ269巻5号:332-336、2019.
5) 高倉喜信、「核酸医薬開発の現状と展望」、医薬ジャーナル55巻2号:585-590、2019.
6) 山田陽史、「siRNA医薬の開発動向」、実験医学37巻1号:15-20、2019.
7) 佐藤悠介、原島秀吉、「siRNAのDDS開発の現状と展望」、医薬ジャーナル55巻2号:615-619、2019.
8) 小比賀聡、「核酸医薬の糖部および塩基部に対する化学修飾」、最新医学73巻6号:760-767、2018.
9) 厚生労働省、「先駆け審査指定制度について」、令和元年9月6日、2019.
https://www.mhlw.go.jp/seisakunitsuite/bunya/kenkou_iryou/iyakuhin/topics/tp150514-01.html
10) 独立行政法人医薬品医療機器総合機構、「医薬品の先駆け審査指定制度の対象品目一覧表」、令和元年9月19日、2019.
https://www.pmda.go.jp/review-services/drug-reviews/0003.html
11) 日本新薬株式会社、2019年8月22日付ニュースリリース、2019.
12) 日本新薬株式会社、2019年9月26日付ニュースリリース、2019.
13) 国立研究開発法人国立精神・神経医療研究センター、2019年9月26日付プレスリリース、2019.
14) 文部科学省科学技術・学術政策研究所、科学技術予測調査
https://www.nistep.go.jp/research/science-and-technology-foresight-and-science-and-technology-trends
15) 新飯田俊平、「新たな核酸創薬への期待-マイクロRNA研究の最近の動向-」、科学技術動向、2011年7・8月号:24-33、2011.


