- PDF:PDF版をダウンロード
- DOI: https://doi.org/10.15108/stih.00412
- 公開日: 2025.09.25
- 著者: 佐々田 槙子、高山 和雄、坪山 幸太郎、科学技術・学術政策研究所 企画課(編集)
- 雑誌情報: STI Horizon, Vol.11, No.3
- 発行者: 文部科学省科学技術・学術政策研究所 (NISTEP)
ナイスステップな研究者から見た変化の新潮流
ナイスステップな研究者2024の御紹介(1)
東京科学大学 総合研究院 難治疾患研究所 教授 高山 和雄
東京大学 生産技術研究所 講師 坪山 幸太郎
科学技術・学術政策研究所 企画課(編集)
科学技術・学術政策研究所(NISTEP)では毎年、科学技術イノベーションの様々な分野において活躍され、日本に元気を与えてくれる方々を「ナイスステップな研究者」として選定している。
2024年12月17日(火)に選定した10名の「ナイスステップな研究者 2024」選定者のうち、本稿では、佐々田 槙子氏(東京大学大学院 数理科学研究科 教授)、高山 和雄氏(東京科学大学 総合研究院 難治疾患研究所 教授)、及び坪山 幸太郎氏(東京大学 生産技術研究所 講師)の3名の研究活動等を御紹介する。
キーワード:ナイスステップな研究者

2011年 東京大学大学院 数理科学研究科 博士課程修了(数理科学)
2011年 慶應義塾大学 理工学部 数理科学科 助教
2014年 慶應義塾大学 理工学部 数理科学科 専任講師
2015年 東京大学大学院 数理科学研究科 准教授
2017年 理化学研究所 革新知能統合研究センター 数理科学チーム 客員研究員(兼務)
2023年 東京大学大学院 数理科学研究科 教授
研究だけでは研究はできない!
数学の楽しさをたくさんの人と共有したいという思いで、「数理女子」というwebサイトを有志の方々と共に運営しています。「おいでMath談話会」や、学内向けの「数理ランチタイム」といった企画も行ってきました。
プライベートでは10才と5才の子育て中で、仕事以外はほぼ全て、子供のことで時間も頭の中も占められています。2人目はニューヨークに長期滞在中に出産しました。日本以外での出産ということだけでドキドキしていましたが、パンデミックが正に始まったばかりの2020年5月の出産となり、アメリカと日本の違いをいろいろな点で目の当たりにしました。特に印象的だったのが、家族の立会い出産についてです。感染拡大の懸念から、3月に感染が広がるとすぐに病院側が立会いを許可しなくなりましたが、母親がパートナーと共に出産を迎えることは重要な基本的権利であり、父親が自分の子供の誕生に立ち会うことも同様に重要な権利である、という市民からの訴えが広がり、3月末にはニューヨーク市長が立会い出産を必ず認めるように病院に指示を出したのです。5月の私の出産時には、夫も当然のように立ち会うことができました。一方、日本で出産した友人からは、2021年になっても、立会い出産どころか退院までの1週間ほど一度も誰とも面会を認められなかったといった話を聞きました。そもそもアメリカでは無痛分娩が当たり前で、そのため産後は2泊で退院しました。
家族、権利、安心安全、政治家、などの在り方や捉え方の違いについて、いろいろと考えさせられる印象的な経験でした。いつも子供たちのおかげで、広い世界を知り、新しい経験をし、様々な人と出会うことができて、感謝しています。最近は、サッカーと塗り絵の楽しさに目覚めつつあります。仕事のことを一旦忘れ、全く新しい刺激を得る時間が、実は研究の充実にもつながっていると強く感じています。
研究のポイント
原子や分子などの目に見えない小さな構成要素からなるミクロな世界と、我々がふだん目にしている日常的なスケールであるマクロな世界のつながりを理解するための数学を研究しています。小さな要素が非常にたくさん集まると、集団としてのマクロなスケールでの振る舞いが、一つ一つの要素の性質からは予想できないような面白い性質を持ったり、普遍性と呼ばれる美しい性質を持ったりします。例えば0度を境に水が氷になったり、金属が一定の条件下で磁石になったり、という現象は、このような小さな構成要素が大量に集まることにより起こる現象として理解できます。
こうした大量の構成要素の集団としての振る舞いを説明するには、確率論が役に立ちます。なぜならば、サイコロの目のような「ランダム」な対象というのは、一回の結果からはサイコロの性質はほとんど分からないけれど、非常に多くの回数を振る、あるいは、非常にたくさんの(同じ性質を持つ)サイコロを同時に振ることで、どの目がどれくらい出やすいのか、というサイコロの持つ「法則」を知ることができます。このように、「1つの原子や分子の情報からはマクロ現象についてのことはほとんど分からないけれど、非常にたくさん集めてくることで、全体の性質が明らかになってくる。」というミクロとマクロの持つ構造を、確率論は見事に表現しているのです。
物質や熱の拡散現象も、一つ一つの要素のバラバラな動きだけからはマクロな世界での拡散の法則は説明できないけれど、バラバラに動いているものが大量にあることによって理解できます。例えば、コップに水を入れて、赤いインクを一滴落とすと、綺麗に丸く広がっていきますが、インクに含まれる一つ一つの分子は勝手に別々の方向に動いているだけであり、みんながバラバラに動くことで、結果的に綺麗な丸ができあがるのです。
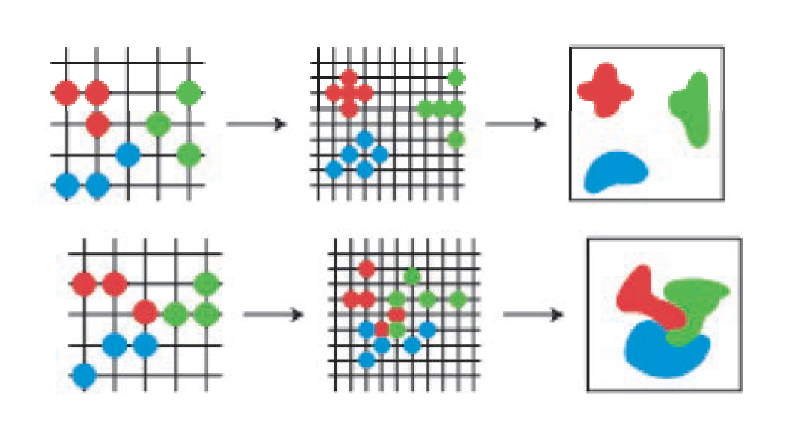
ミクロとマクロのつながりについては、物理的にも数学的にも分からないことがまだたくさんあります。特に、拡散現象のような時間的に変化するマクロ現象を説明する方法の一つである「流体力学極限」という理論を専門にしています(定理のイメージは図表1を参照)。
「流体力学極限」は30年以上にわたり研究されていますが、個別の数理モデルごとに証明をするという状況が未だに続いており、様々なモデルを統一的に理解し、ミクロモデルが持つ本質的な条件は何かを明らかにすることを目指しています。そのために、確率論だけでなく、幾何学や代数学などの概念を取り入れることで、普遍的な枠組みの構築を行ってきました。
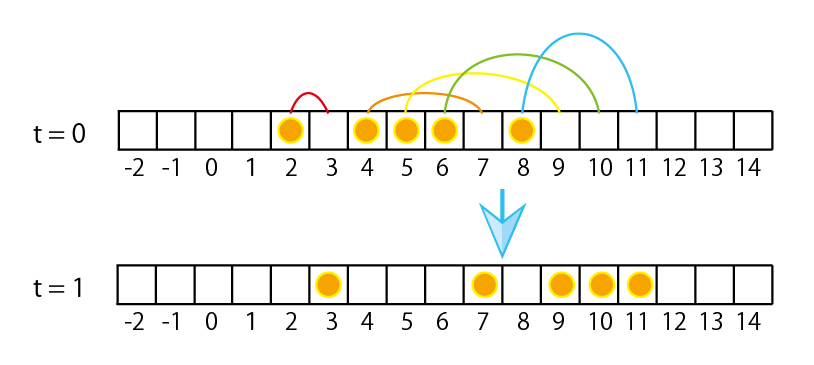
また、可積分系(典型例である箱玉系については図表2を参照)と呼ばれるこれまで流体力学極限の適用対象とは考えられていなかったタイプのモデルに対して、流体力学極限と同様の結果が得られることを近年示しました。これらの研究は全て、幾何学、代数学、可積分系、など、元々私が専門としていた確率論とは違う分野の専門家と出会ったことで実現したものです。共同研究のきっかけもそれぞれ異なりますが、実はどれも研究活動と直接には関係のない偶然の産物です。魅力的で新しい世界をいつも教えてくださる共同研究者の皆さんに心から感謝しています。
若手研究者や読者へのメッセージ
小さい頃から数学が好きで、何か数学に関わる仕事をしていたいと思っていましたが、学生の頃は「すごく数学のできる人」が周りにたくさんいて、自分が研究者になれるという気が全くしていませんでした。また、数学の研究というのは孤独に行うものと想像していて、それを一生やるのは辛いかもしれない、とも漠然と感じていました。
今大学教員になってみて、同じように感じている学生と出会うこともたくさんあります。そうした学生や昔の自分に伝えたいことは、人と比べることは意味がないこと、研究は「競争」ではなく「共創」だということです。研究に大切なことは、まず粘り強く続けることです。そのためには、粘り強く続けたいと思えるような、情熱を持てる研究テーマに出会うことが必要です。この情熱の源は、シンプルな好奇心、社会課題を解決したい、身近な人を助けたい、など人それぞれですが、何かに強い情熱を持てるということは、テストの点数がいいことや、難しい理論をすらすら理解できることとは全く別です。
そしていざ研究を始めてみると、目指すものは「誰かに勝つ」ことではなく、自分が実現したい研究目標の達成です。そのためには粘り強さに加えて独創的な発想も時に必要になりますが、特に数学では実験などがないので、画期的なアイディアの多くは他の研究者と議論する中で生まれてきます。周囲の研究者らと共にそれぞれの持つ知見や能力を生かして新しいものを創造すること、つまり共創こそが、研究者には大切なのです。
“数学者はコーヒーを定理に変える機械”、という有名なフレーズがありますが、コーヒーは研究者同士が会話を始めるための重要なきっかけで、大学や研究集会でのコーヒータイムは休憩ではなく研究活動の非常に重要な部分と言えます。成果を出さねばと焦っていると、コーヒータイムなどに顔を出す余裕がないと感じるかもしれませんが、こうした活動に時間や予算をかけることが、実は研究成果に大きくつながるということを、若手研究者の方、そして研究活動を様々な形で支えていただいている方々にも是非、知っていただけると幸いです。
難治疾患研究所 教授

2015年 大阪大学大学院 薬学研究科 博士課程修了
2015年 大阪大学大学院 薬学研究科 特任助教
2018年 大阪大学大学院 薬学研究科 助教
2020年 京都大学 iPS細胞研究所 講師
2025年 東京科学大学 総合研究院 難治疾患研究所 教授
iPS細胞やオルガノイド、臓器チップを用いた感染症研究
オルガノイドや臓器チップは、生体外でヒト臓器を構築する技術として、近年注目を集めています。オルガノイド技術を用いることで、幹細胞から三次元的な臓器様構造体を作製することが可能です。一方、臓器チップは、微細加工技術を用いて作られた小型のデバイス上にて細胞を培養し、気流や液体の流れなどの力学的刺激を加えることができるため、より実際の臓器に近い環境を再現することができます。
これらの技術を活用することで、生体外において機能的なヒト臓器モデルを構築し、それを用いて疾患状態を再現することで、病気のメカニズムをより深く理解することが可能となります。また、このようなヒト臓器モデルを用いた研究は、新たな治療薬の開発にもつながると期待されています。
私はこれまで、オルガノイド及び臓器チップ技術を活用し、肺や腸管といった臓器のモデルを開発してきました。これらのモデルを応用し、特にウイルス感染症の研究に取り組んできました。
具体的には、各臓器モデルにウイルスを感染させ、その応答を解析することで、ウイルスがヒトの臓器に対してどのような影響を与えるのかを明らかにしてきました。
さらに、どのような薬剤がウイルスに対して有効かを検証する研究も行ってきました。2025年7月の講演では、オルガノイド及び臓器チップ技術を用いた生体外での臓器創出の現状と、現在直面している課題について御紹介しました。そして、これらの技術が今後どのように医療へ応用されていく可能性があるのかについて議論でき、有意義だったと考えております。
研究のポイント
iPS細胞やオルガノイド、臓器チップといった技術の登場によって、生体の外でヒトの臓器に似た構造物を作製することが可能になりました。これらの構造物を用いることで、ウイルスがヒトの臓器に与える影響を、実際の人体を使うことなく安全に調べることができます。例えば、呼吸器の組織に似た構造物を生体外で作り、そこに新型コロナウイルスを作用させることで、このウイルスが呼吸器にどのような障害を起こすのかを解析することが可能になりました。これにより、感染や発症のメカニズムを詳しく調べ、それに対処するための治療法を見つけることができるようになりつつあります。
私は、2020年に新型コロナウイルスの感染拡大(いわゆる「コロナ禍」)が始まった年に、京都大学iPS細胞研究所で研究室を立ち上げました。当時は新型コロナウイルスに関する科学的知見がまだ十分に得られておらず、新型コロナウイルスが人体にどのような影響を与えるのかを明らかにする必要がありました。そのため、私はiPS細胞やオルガノイド、臓器チップといった技術を駆使してヒト臓器モデルを作製し、それを用いて新型コロナウイルスの研究に取り組みました。
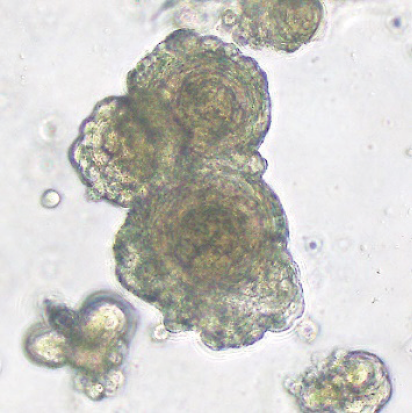
オルガノイドとは、iPS細胞などから作られる「ミニ臓器」のようなもので、ヒトの臓器に近い三次元構造を有しています(図表3)。また、臓器チップ(生体模倣システムとも呼ばれています)とは、臓器の構造や機能を模倣した小さな装置で、生体内に存在する「流れの刺激」や「伸び縮みの刺激」など、実際の臓器にかかる物理的な負荷を再現できます(図表4)。これらの技術により、体の中に近い環境で細胞を培養し、ウイルス研究を含む応用研究を高精度に実施できるようになります。
私はこれまでに、呼吸器オルガノイドや呼吸器チップを開発し、新型コロナウイルスが呼吸器に与える障害のメカニズムを明らかにしてきました。さらに、ウイルスの感染を防ぐための方法の開発や、障害を受けた呼吸器を回復させるための創薬研究も行ってきました。2023年には、新型コロナウイルス感染症が感染症法上の「5類感染症」に移行し、社会も落ち着きを取り戻しています。それを機に、私は新たな研究として、腸管に感染するウイルスの研究に使用できる腸管チップの開発も行いました。
新型コロナウイルス感染症は、世界中で大きな混乱を引き起こしました。しかし、歴史を振り返ると、ウイルスによるパンデミック(世界的な大流行)は定期的に発生しています。次のパンデミックに備えるためには、平時の今だからこそ、感染症とその創薬に関する研究を地道に進めておく必要があります。私は、コロナ禍で培ってきた技術や経験を生かし、iPS細胞やオルガノイド、臓器チップといった技術を最大限に活用しながら、ウイルス感染症の創薬研究を今後も継続していきたいと考えています。

若手研究者や読者へのメッセージ
この度、「ナイスステップな研究者2024」に選ばれたことを、心から嬉しく思っております。私は、iPS細胞やオルガノイド、臓器チップなどの技術を使って、臓器モデルを作る研究を行っています。この臓器モデルを使って、ウイルスが人体にどのように影響するのかを調べる研究を行ってきました。例えば、新型コロナウイルスが肺に入ったときにどのような反応が起こるのか、どのような薬が効くのかを調べました。
私がこれまで研究を継続できたのは、大阪大学、京都大学、そして現在所属している東京科学大学で、多くの先生方や仲間たちに支えていただけたからです。自分一人の力では乗りこえられなかった困難も、周りの人の支えがあったからこそ、乗りこえることができました。この場をお借りして、これまで助けてくださった全ての方々に心から感謝申し上げます。今、これまでの研究を振り返ってみると、大きな成果が出せたときには、必ず共同研究者の御支援がありました。私はまだまだ勉強中の身ですが、もし、かつての自分のように悩んでいる若手研究者がいたら、私もその人の背中をそっと押せるような存在になりたいと思っています。
これからも、オルガノイドや臓器チップを使って、ウイルス感染症を含む疾患の仕組みを深く理解し、治療に役立つ新しい薬を生み出すという大きな目標に向かって、全力で研究を続けていきたいと思います。この文章を読んでくださった皆様、そして私の研究に興味を持ってくださった皆様に、「この人を応援したい」と思っていただけるような研究者になれるよう、これからも一歩ずつ進んでいきます。

2016年 東京大学 医学部 卒業
2019年 東京大学大学院 新領域創成科学研究科 博士後期課程修了
2019年 東京大学 定量生命科学研究所 日本学術振興会 特別研究員(PD/CPD)
2020年 Northwestern大学 日本学術振興会 特別研究員(CPD)・Long-Term Fellowship of the Human Frontiers Science Program
2023年 東京大学 生産技術研究所 生体分子設計工学分野 講師(独立研究者)
社会で有用なタンパク質を自由自在に設計するために
幼稚園・小学生の頃から、いわゆる「理科」の科目が好きで、加古里子さんの絵本はよく読んでいました。小学1年生のときの作文に「目指すは理科です」ということを書いていたそうです。その後、中高生になるにつれて、数学に興味が移り、比較的統一的な法則が説明されている化学・物理、あとは政治経済の特に経済分野に強い興味を持っていました。その後、紆余曲折あり、最終的には医師になることを決意し、東京大学・医学部に入学しました。
医学部では、正規授業の傍らで、水島昇先生の研究室にお世話になることになり、顕微鏡を使った研究を体験させていただく中で、生物学、特にタンパク質を中心とする分子生物学への興味を持つようになりました。高校生のうちは暗記科目のように感じて、勝手に苦手意識を持っていた生物が実は、特に分子の視点から見ると、ある程度、理論だって説明することができるということに感銘を受け、基礎生物学者としての博士課程へと進学することを決意しました。
その後、博士課程では、特にRNAサイレンシングを中心に研究されている東京大学・定量生命科学研究所の泊幸秀先生の研究室へと進学しました。ここでは、1分子FRET計測といわれる2種類の異なる蛍光色素を用いて、距離の変化を時系列に観測する技術で、タンパク質が機能するための構造変化を観察するという研究を行いました。また、加熱しても凝集しない不思議な性質を示す「Heroタンパク質」群を発見することもでき、タンパク質が極めてユニークな物質であるということを痛感しました。
その後、情報科学を活用したタンパク質研究を行いいたいと思い、Northwestern大学のRocklin研究室に留学、そこでタンパク質を大規模に解析する方法を修得し、今に至ります。
研究のポイント
主に、人工タンパク質を合理的に設計する研究を行っています。身体の主要な構成因子であるタンパク質は、20種類のアミノ酸が連なっている多量体です。多様なアミノ酸同士が相互作用することで、そのような多量体が複雑な構造を形づくり、タンパク質は多様な機能を生み出すことができます。例えば、100個アミノ酸が並んでいると、1箇所について20通りの可能性があるため、タンパク質の種類は、20の100乗という途方もない数になります。その数は非常に膨大で、宇宙の原子の数よりも多いと言われており、タンパク質が持つ潜在能力の高さを物語っています(図表5)。
それだけ多種多様なタンパク質が存在しますが、生物が活用しているタンパク質は10の12-16乗程度と推定されており、タンパク質全体のごくごく一部でしかありません。つまり、高いポテンシャルがあるにもかかわらず、生物はタンパク質の多様な機能を余すことなく使いこなしてはいないのが現状です。そこで、人工タンパク質を設計できれば、従来の生物では活用できていなかったポテンシャルを活用できるのではないかと考え、研究に取り組んでいます。
例えば、新型コロナウイルスの感染を防ぐようなタンパク質を設計することができます。ただし、2020年当時の技術では、その設計の成功率は0.01%程度でした1)。執筆時点の2025年自体では、いわゆるAIを活用した技術革新が起き始めていて、1%程度前後には改善はしています2)が、それでも宝くじで一等を当てるような運任せの設計になってしまっています。このような現状を打破しようと、人工タンパク質の合理的な設計の研究に取り組んでいます。
そもそもなぜ成功率が低いのかというと、一番の理由は、タンパク質の基本的な法則が解明されていないからです。タンパク質は非常に複雑な立体構造ですが、元々はアミノ酸が連なった1本鎖です。この長い鎖が、どのようにして複雑な構造を形づくるのか。どのようにアミノ酸を配列させれば、きちんとした構造を保つことができるのかが、よく分かっていません。こうした基本法則が解明されていないため、人工タンパク質もどうやって構造をつくり、その構造がどのようにして機能を果たすのかを、なかなか解き明かせないでいます。そこで人工タンパク質の合理設計を実現するために、タンパク質の基本法則を解明するという基礎的なテーマを中心に取り組んでいます。
タンパク質の法則を解明するために、必要なツールは、深層学習をはじめとする機械学習技術と高品質かつ大規模なデータであると私は考えています。この2つでは、機械学習・深層学習技術は目覚ましい発展を遂げている一方で、データの種類・規模の拡張は停滞しています。例えば、タンパク質の構造に関しては、非常に優れたデータベースがあるのですが、その一方で、タンパク質の機能や性質については、役立つデータセットがほとんどないのが現状でした。そこで、私は構造安定性といったタンパク質の性質を大規模に解析できるデータの取得可能な方法を構築・発表しました3)。さらに、このデータセットを活用することにより、構造安定性の予測モデルを構築しています。また、このデータセットは、世界中の研究者の方々にも活用されています。このように高品質かつ大規模なデータセットを取得することにより、少しずつですが、精度の高い人工タンパク質の設計が現実のものになりつつあります。
私たちは、この流れを加速させるために、深層学習で活用されるような高品質なデータセットの取得に努めています。例えば、人工タンパク質を医学・工学分野で活用するためには、安価に大量に製造することが求められますので、タンパク質の生産性に注目したデータセットも構築しています。このような研究を通じて、人工タンパク質の合理設計を押し進め、人工タンパク質が社会で活躍する下支えをしたいと思っています。

若手研究者や読者へのメッセージ
あくまで私の経験によるところにはなりますが、是非、自分自身の興味を大切にしながらも、分野を狭めすぎずに、その興味の周辺を探索するということを念頭に、特に修士・博士学生で過ごす研究室を選んでほしいと思っています。私自身、自己紹介の部分にも記載したように、いろいろな分野を経験し、自分の中でそれらを統合できる力を身に付けることで、今のような研究テーマを見いだすことができました。
もう一つは、特に学生のときには、なるべく多くの実験を実施して、論文を元に新しい手法を研究室に自分自身で導入するということを試してもらいたいと思います。2023年に発表し、Rocklin研究室で実施したタンパク質の構造安定性を大規模に測定する手法の開発において、それ以前に在籍していた泊研究室で導入を試みましたが、結局最終的には活用しなかった手法が極めて有用でした。この例のように、元々の想定とは異なる形で実を結んだということも度々経験しています。
一見遠回りに見えることかもしれませんが、様々なテーマ、研究を実施されることが、後々役立つことが多いはずです。
※ 本記事内の図表はすべて2025年NISTEP講演会のスライドから掲載。
参考文献
1) Cao, Science 2020
2) Watson, Nature 2023
3) Tsuboyama, Nature 2023


