- PDF:PDF版をダウンロード
- DOI: https://doi.org/10.15108/stih.00189
- 公開日: 2019.09.25
- 著者: 矢口 雅江
- 雑誌情報: STI Horizon, Vol.5, No.3
- 発行者: 文部科学省科学技術・学術政策研究所 (NISTEP)
レポート
再生医療の推進状況と産学官民の協働を牽引する
日本再生医療学会の取組
再生医療は、従来の手法では治療困難な疾患の根本治療になり得る新しい医療技術であり、実用化が期待されている。大学・公的研究機関の研究成果を実用化へつなげるには、臨床研究の促進及び企業との連携による産業化が必要になる。一般社団法人日本再生医療学会(JSRM)は、国費投入型事業「再生医療等臨床研究を支援する再生医療ナショナルコンソーシアムの実現」の中で、再生医療の臨床研究及び産業化を加速させる取組を行っている。事業は5つのユニットで形成され、①再生医療等臨床研究の支援、②再生医療に携わる人材育成及び教育の推進、③再生医療における症例データベースの構築及び運用、④産学連携による再生医療の社会的実装の推進、⑤患者・市民参画によるコミュニケーションを実施している。この事業は、組織の垣根を超えた知識と経験の国家規模の共有知化を実施し、組織間の利害関係を排して再生医療を加速させる協働モデルを構築し、全国規模のコンサルテーションや専門人材育成など幅広い活動を先導していることから、第1回日本オープンイノベーション大賞を受賞した。
キーワード:再生医療,日本再生医療学会,ナショナルコンソーシアム事業,産学官民の協働,
オープンイノベーション
はじめに
近年、日本の再生医療は、臨床研究・治験の段階へと進んできており、実用化が待たれている。実用化を促進させるには、大学・公的研究機関と企業との連携による産業化が必要である。本稿では、国内における再生医療の動向を概観するとともに、産学官民の協働モデルを構築しながら再生医療の臨床研究並びに産業化の促進に取り組む一般社団法人日本再生医療学会(JSRM)のユニークな事業活動について紹介する。
1. 再生医療の推進
1-1 再生医療への期待
日本における臓器移植希望登録者数は約14,000人であるのに対し、1997年10月に「臓器の移植に関する法律」が施行されてから2019年5月末までの脳死下臓器提供は、累計603例であり1)、ドナー不足や拒絶反応のリスクなどが障壁となっている。再生医療は、患者自身の細胞・組織又は他者の細胞・組織を培養等加工したものを用いて、失われた組織や臓器を修復・再生する医療2)とされている。再生医療による治療法は、①体外で人工的に培養した幹細胞3)等や人工的に構築した組織、②生きた細胞を組み込んだ機器等を、患者の体内へ移植する細胞治療と、③内在性幹細胞を活性化させて組織の再生を促す薬物治療に大別される。生涯治療を必要とする慢性疾患や高齢化に伴う疾患など、従来の手法では治療困難な組織や臓器の根本治療になり得ることから、再生医療の実用化に関心と期待が高まっている。
1-2 政府による再生医療の推進と制度
日本における再生医療は、文部科学省、厚生労働省、経済産業省の3省が連携して基礎研究から産業化、実用化まで一貫した推進体制が図られている。2003年より文部科学省は「再生医療の実現化プロジェクト」を実施し、幹細胞・再生医学研究を国内4拠点(京都大学、慶應義塾大学、東京大学、理化学研究所)で重点的に推進してきた。2006年に新しい多能性幹細胞としてiPS細胞が開発され、2007年にヒトiPS細胞が樹立されると、画期的な新技術として、再生医療の研究分野で扱われるようになった。
2012年にiPS細胞の研究で京都大学山中伸弥教授がノーベル生理学・医学賞を受賞後、2013年5月に「再生医療を国民が迅速かつ安全に受けられるようにするための施策の総合的な推進に関する法律」(「再生医療推進法」)が施行された。これを受け、「再生医療の迅速かつ安全な研究開発及び提供並びに普及の促進に関する基本的な方針」が2014年11月に閣議決定され、再生医療を国家プロジェクトとして推進するための基本方針(医療としての実用化、製品としての実用化)が示された。
2014年11月、再生医療に関する2つの法律が施行された。「再生医療等の安全性の確保等に関する法律」(以下「再生医療等安全性確保法」)、及び「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(以下「医薬品医療機器等法」)である。「再生医療等安全性確保法」注1は、臨床研究や治験を行う際の規定で、再生医療等の安全性の確保に関する手続や、細胞培養加工の外部委託のルール等が定められた。「医薬品医療機器等法」注2は、「薬事法」が改正されたもので、改正薬事法、薬機法とも呼ばれる。再生医療等製品が定義されて、従来の医薬品、医療機器、医薬部外品、化粧品に新しく加えられ、品質・有効性・安全性の確保、及び保健衛生に関する規制が定められた。また、新しい審査制度も創設され、治験から有効性が“推定”され、安全性が認められた場合に、条件及び期限付(原則として最長7年)で早期に製造販売が承認される「条件及び期限付承認制度」が導入された。これにより、従来10年以上かかっていた製造販売承認プロセスが短縮可能となり、市販後に有効性の検証と更なる安全性の確認を行い、期限内に再度承認申請を行うこととなった。
1-3 国立研究開発法人日本医療研究開発機構(AMED)4)の再生医療事業
医療分野における国の研究支援体制は、従来、文部科学省、厚生労働省、経済産業省に予算配分され、各省で運用されていた。これらを集約して基礎から実用化までの研究開発業務を一体化するため、「国立研究開発法人日本医療研究開発機構法」が公布され、2015年4月にAMEDが創立された。
AMEDが実施している再生医療に関する事業には、「再生医療実現プロジェクト」がある(図表1)。文部科学省は、基礎研究、応用研究、非臨床研究までを担当し、厚生労働省は、臨床研究・治験を担当、経済産業省は、基礎研究から臨床研究・治験までをカバーする形で各支援事業が行われている。この事業は、基礎研究から臨床研究・治験まで切れ目のない研究支援体制を築いている。

2. 再生医療の実用化状況
2-1 医療としての実用化
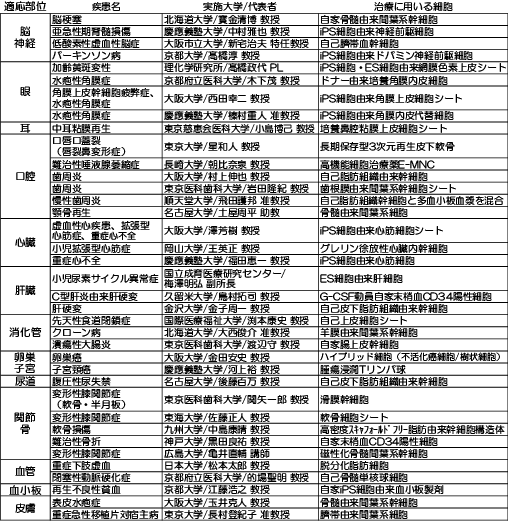
再生医療等の実施に関しては、「再生医療等安全性確保法」に基づく公開データが厚生労働省から発表されている5)。2019年5月末時点までに提出された再生医療等提供計画数は、治療3,723件、研究139件となっている。AMEDが推進する「再生医療実用化研究事業」では、現在取り組まれている臨床研究・治験課題48件が紹介されている6)。そのうち、適応部位からみた課題を図表2に示した。最新の治験実施状況としては、2019年7月に実施された角膜上皮幹細胞疲弊症に対するiPS細胞由来角膜上皮細胞シート移植(大阪大学)がある。また、亜急性期脊髄損傷に対するiPS細胞由来神経前駆細胞の移植(慶應義塾大学)等が2019年に予定されている。
2-2 製品としての実用化
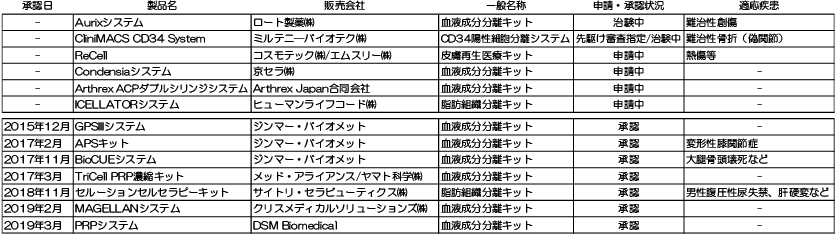
再生医療等製品の実用化を促進させる制度は、「条件及び期限付承認制度」のほかに、「先駆けパッケージ戦略」注3による「先駆け審査指定制度」がある。この制度は、「日本再興戦略」改定2014年注4に基づき、世界に先駆けて革新的医薬品・医療機器・再生医療等製品を日本で早期に実用化するため、早期治験段階で有効性が見込まれた場合に先駆け審査指定が受けられ、承認審査期間を短縮する制度である。再生医療等製品は、11品目が先駆け審査指定を受けている(図表3)。
2019年7月現在、日本で承認された再生医療等製品は、7品目となっている(図表4)。このうち、2016年2月に「STR01」として先駆け審査指定を受けた「ステミラック注」は、2018年12月に条件及び期限付承認を受け、2019年2月に薬価収載されている。
再生医療等製品のほかに、再生医療等の提供において、細胞加工物を製造した医療機器についても、「再生医療等安全性確保法」に基づく承認手続が必要になる。細胞加工物を製造する医療機器の開発状況を図表5に示した。2019年7月時点で先駆け審査指定を受けている医療機器は1件、承認は7件となっている。


2-3 産業界の動向
再生医療の社会実装には、再生医療等製品の開発以外に、培地や試薬類などの周辺産業も必要となる。再生医療の産業化促進は、一般社団法人再生医療イノベーションフォーラム(FIRM)7)が主導している。FIRMでは、製品化を目指した研究開発から臨床治験、承認取得、国内外での普及をワンストップで促進するため、大学・公的研究機関と企業を結ぶ基盤づくりや、周辺産業との新しい枠組み構築による体制整備を行っている。
2019年7月に開催された第1回再生医療産業化展(東京)では、再生医療等製品のうち、細胞治療薬、遺伝子治療薬は海外製品が1件のみであった。それ以外の周辺産業は230件を超え、半数近くが海外製品で占められていた。培地や試薬類などの消耗品は全体の2割で、それ以外は自動培養装置、支援ロボット、解析サービス等の製品が目立った。
経済産業省が発表した報告書8)によると、再生医療の将来市場規模は、2020年以降急速に拡大し、周辺産業も大きな市場を形成して経済効果が見込まれると予測している。FIRMに登録された企業数は、2019年4月時点で250社を超え、産業化と国際標準化の推進により、世界市場への拡大を目指している。
3. 一般社団法人日本再生医療学会(JSRM)9)の取組
3-1 大学・公的研究機関と企業をつなぐ学会総会
2019年3月、第18回日本再生医療学会総会(神戸)が開催され、約4,000人が参加した。JSRMは2001年に発足し、学会会員数は当初の約1,000人から2018年度には約6,000人に増加している。学会総会で発表された研究内容は、基礎研究、臨床研究、治験、医薬品・周辺機器開発、倫理・安全性評価指標開発、細胞保存・輸送技術開発、自治体支援政策など多岐にわたり、約15%は民間企業からの発表だった。学会総会開催期間中、学会参加者向けに最新技術・製品紹介用に展示会室が設けられ、シーズ紹介、商談、技術相談の場が提供された。
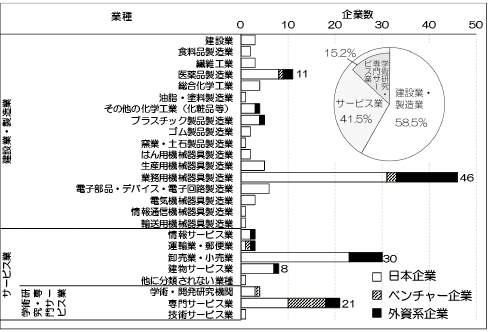
学会総会で最新技術紹介コーナーに出展した企業171社を業種別に調べたところ、建設業・製造業58.5%、サービス業41.5%だった(図表6)。外資系企業は全体の17.5%、国内の大学ベンチャー企業は9.2%だった。製造業では、医療用機械器具等を販売する「業務用機械器具製造業」46社、「医薬品製造業」11社が多く、サービス業では研究用試薬類など消耗品類を主に扱う「卸売業・小売業」30社、「専門サービス業」21社、「建物サービス業」8社が多かった。大学ベンチャー企業は、サービス業のうち「学術研究・専門サービス業」に多く、解析・受託サービス等を行う「専門サービス業」に集中していた。これらの傾向は、再生医療産業の一部分を表しているにすぎないが、FIRMに所属する企業が出展企業の約4割と半数以下であることから、応用技術で再生医療分野へ新規参入を試みる企業の存在が示唆される。
3-2 再生医療の臨床研究及び産業化の推進活動
再生医療の実用化には、臨床研究・治験の段階で産業界との連携が必要とされる。第18回日本再生医療学会総会で行われたシンポジウムでは、産学連携推進の重要性について議論が行われ、JSRMの「再生医療等臨床研究を支援する再生医療ナショナルコンソーシアムの実現」事業(以下ナショナルコンソーシアム事業)の活動がトピックとなった。
3-2-1 ナショナルコンソーシアム事業注5
ナショナルコンソーシアム事業は、AMED「再生医療実現プロジェクト」(図表1)の「再生医療臨床研究促進基盤整備事業」に採択された事業である。オールジャパン体制での研究発展による日本全体の再生医療臨床研究のボトムアップを目的とし、2016年より取り組まれている。事業は、以下5つのユニットに分かれて活動が行われている(図表7)。
① 臨床研究支援ユニット
再生医療等における臨床研究や治験の実施には、「再生医療等安全性確保法」に準じた様々な手続が必要となる注1。このユニットでは、大学・公的研究機関と企業に対して、(1)臨床研究等のプロトコルに対する助言、(2)再生医療等提供計画書の作成支援、(3)研究環境・設備運用に関する助言、(4)再生医療等提供計画ひな形の公開を行い、臨床研究を促進している注6。
② 人材育成ユニット
再生医療に携わる人材に対して、(1)医師・歯科医師及び細胞培養加工の技術者等を養成するカリキュラム等の作成や研修会の実施、(2)再生医療に関する法制度の教育、(3)医師・歯科医師に対する倫理教育、(4)認定再生医療等委員会の委員に対する教育を実践している。また、再生医療の従事者向けに、再生医療の教科書として「テキストブック再生医療~創る、行う、支える~第1版」を発刊した。
③ 再生医療等データベースユニット
再生医療等症例データベース(National Regenerative Medicine Database; NRMD)10)は、臨床研究(Clinical Research; NRMD/CR)から市販後調査(Post Marketing Study; NRMD/PMS)をカバーしている。市販後調査は、副作用を中心としたデータのほか、条件及び期限付承認後の市販後調査のデータも含んでいる。CSV注7及びGPSP省令(「医薬品の製造販売後の調査及び試験の実施の基準に関する省令」)に準拠した品質で管理が行われ、真正性の高いデータセットとして「医薬品医療機器等法」に基づく臨床データの利用に厚生労働省から推奨されている注8。手術等による侵襲性の高い治療や重症患者を対象とした治療等の場合、データベースに登録された過去の統制群を用いて比較試験を行う、といった利用も可能となる。
④ 産学連携ユニット
大学・公的研究機関と企業との橋渡し事業として、イベントや検討会を開催している。「再生医療産学連携バリューチェーンセミナー」は、培養装置、輸送、検査、消耗品、知的財産権などをテーマに取り上げ、産学双方からの問題点を抽出して議論する場を提供している。「再生医療産学連携テクノオークション」は、学会総会に合わせて開催され、大学・公的研究機関のシーズを企業に紹介して事業化の可能性を探る“マッチングの場”を提供している。その他、再生医療における標準化ワーキンググループを発足させている。
⑤ 患者・市民参画ユニット
患者・市民の視点を反映した「責任ある研究・イノベーション(RRI)」を実現させるための事業で、市民とのコミュニケーション活動が行われている。「患者・社会と考える再生医療」ワークショップイベントでは、研究者が患者やその家族の意見を聴取して、研究の初期段階からプロトコルに生かす、バックキャスト型の臨床研究を支援している。また、再生医療に関する情報案内として、電話相談窓口及び「再生医療ポータル」11)を開設している。
このように、ナショナルコンソーシアム事業は、全国規模のプラットフォームを形成して、企業、大学・公的研究機関、政府、患者・市民(産学官民)をステークホルダーとした協働モデルを構築し、オープンイノベーションの推進を支援している。

3-2-2 日本オープンイノベーション大賞受賞12)
ナショナルコンソーシアム事業は、5つのユニットにおける活動を通して、組織の垣根を超えた知識と経験の国家規模の共有知化を実施し、組織間の競合などの利害関係を排して再生医療を加速させる協働モデルを構築し、かつ、全国規模のコンサルテーションや知財管理、専門人材育成など幅広い活動を先導していることから、2019年3月に内閣府が実施する第1回日本オープンイノベーション大賞において、日本学術会議会長賞を受賞した。
3-3 その他の取組
JSRMは、資格認定制度として、再生医療認定医認定制度、臨床培養士認定制度を実施している。また、政策提言、産学官連携シンポジウムや学会総会開催に合わせた市民公開講座の開催注9など、再生医療研究に携わる人材に対する実務的支援並びに市民に対しての情報提供を行い、産業化に向けた課題解決のための問題提起や議論の場を提供している。
終わりに
日本における再生医療の実用化に向けた取組は、医療としての実用化と、製品としての実用化の2つの方針で推進されている。医療としての実用化は、臨床研究・治験の段階に進んできており(図表3)、製品としての実用化は、承認を迅速化する制度が導入されたが、欧米で市販されている幹細胞等を利用した医療製品13)と比べて製品数はまだ少ない(図表4、図表5)。実用化を促進するには、研究開発の成果を事業化、産業化する必要がある。JSRMは、2016年よりナショナルコンソーシアム事業の活動を通して、国内で実施される再生医療における臨床研究並びに産業化の促進に貢献している。厚生労働省では、2017年に「ベンチャー等支援戦略室」を設置し、医療系ベンチャー企業等の総合的支援を行う「MEDISO」を2018年に開設した。また、FIRMでは2018年からアカデミア対象起業塾を開催し7)、事業化を支援している。この様な支援や制度等の利用により、実用化が加速していくと期待される。
再生医療の実用化は、期待が大きいが課題も多い。安全性や有効性等の議論のほかに、経済性の議論も必要となる。臨床研究・治験に用いられる培地や試薬類などの消耗品が高額化しており、研究資金を主に国費で賄う大学・公的研究機関の研究開発推進に影響を与えている。また、多額の研究開発費投入は、開発された医薬品等や医療技術の高額化につながり、医療費膨張の一因になる注10。厚生労働省では、革新性が高く市場規模の大きい医薬品等を対象に、2016年度より「費用対効果評価制度」を試行して価格調整を試み、2019年4月から正式に導入した14)。再生医療等製品では「ジャック」「キムリア点滴静注」(図表4)が対象とされており、FIRMでは、再生医療等製品の価格算定を調査して、厚生労働省に意見陳述を行っている15)。このように、再生医療の実用化を推進するため、産学官が連携したオールジャパン体制で施策の検討や調整が進められているところである。
謝辞
本稿の執筆に当たり、資料のご提供など御協力を賜りました日本再生医療学会 眞野恭輔事務局長、臨床研究支援ユニット 宮澤直美マネージャー、神奈川県立保健福祉大学 八代嘉美教授に、御礼申し上げます。
注1 「再生医療等安全性確保法」(平成25年法律第85号)は、自由診療及び臨床研究・治験を行う際の規定を定めたもので、①再生医療等提供計画の提出、②再生医療等委員会の審査・承認、③細胞培養加工施設の許可・届出・認定、立入検査、④リスク分類(ヒトの生命及び健康に与える影響の程度)に応じた手続、などが制度化された。この法律が指す「再生医療等」とは、再生医療等技術(ヒト又は動物の細胞に培養その他の加工を施した細胞加工物)を用いて行われる細胞治療のこと。再生医療等の“等”は、体外でリンパ球に遺伝子改変を施して人に移植する免疫細胞療法や、美容外科などを含む。
注2 「医薬品医療機器等法」は、「薬事法等の一部を改正する法律」(平成25年法律第84号)により「薬事法」(昭和35年法律第145号)の名称が改正され、再生医療等製品の規制が加えられた。この法律が指す「再生医療等製品」とは、「人又は動物の細胞に培養その他の加工を施したもの」(細胞・組織加工製品、再生医療製品)、及び、「人又は動物の疾病の治療に使用されることが目的とされている物のうち、人又は動物の細胞に導入され、これらの体内で発現する遺伝子を含有させたもの」(遺伝子治療製品、遺伝子治療薬)のことをいう(第二条の9)。
注3 「先駆けパッケージ戦略」2014年6月(厚生労働省)
https://www.mhlw.go.jp/seisakunitsuite/bunya/kenkou_iryou/iyakuhin/topics/tp140729-01.html
注4 「日本再興戦略」改定2014(2014年6月24日閣議決定)https://www.kantei.go.jp/jp/singi/keizaisaisei/pdf/honbun2JP.pdf
注5 ナショナルコンソーシアム事業 https://www.jsrm.jp/news-category/nc
注6 臨床研究支援の活動と実績 https://nc.jsrm.jp/crs/achievements/
注7 CSVとは、コンピュータ化システムバリデーションのこと。「医薬品・医薬部外品製造販売業者等におけるコンピュータ化システム適正管理ガイドライン」(厚生労働省2012年4月施行)の基準。
注8 2017年9月厚生労働省医薬・生活衛生局医薬安全対策課長通知「再生医療等製品患者登録システムへの参加等について(依頼)」において、NRMDの市販後調査(NRMD/PMS) が推奨されている。
注9 「リスクコミュニケーションモデル形成事業」(文部科学省)の活動として市民講座を開催。
注10 厚生労働大臣が定める「評価療養」は、医薬品・医療機器・再生医療等製品の治験に係る診療、医薬品医療機器法承認後で保険収載前の医薬品・医療機器・再生医療等製品の使用、保険適用医療機器・再生医療等製品の適応外使用(使用目的・効能・効果等の一部変更の承認申請がなされたもの)が、先進医療等と並んで指定されている。「評価療養」に指定された医療を受ける場合、通常の治療と共通する部分(診察・検査・投薬・入院等)以外は、患者の全額自己負担になる。
参考文献・資料
1) 第50回厚生科学審議会(疾病対策部会臓器移植委員会)資料「臓器移植医療の現状と対策」2019年6月21日(厚生労働省)
2) 規制・制度改革に関する分科会ヒアリング資料(再生医療の推進)2012年3月12日(厚生労働省)
3) SKIP(Stemcell Knowledge & Information Portal) https://skip.stemcellinformatics.org/knowledge/basic/
4) 国立研究開発法人日本医療研究開発機構(AMED) https://www.amed.go.jp/
5) 「再生医療について」(厚生労働省)
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/kenkou_iryou/iryou/saisei_iryou/index.html
6) 再生医療研究開発2019(AMED) https://www.amed.go.jp/content/000043089.pdf
7) 一般社団法人再生医療イノベーションフォーラム(FIRM) https://firm.or.jp/
8) 「法施行を踏まえた再生医療の産業化に向けた取組」経済産業省生物化学産業課2015
9) 一般社団法人日本再生医療学会(The Japanese Society for Regenerative Medicine; JSRM) https://www.jsrm.jp/
10) NRMD https://nrmd.jp/
11) 再生医療ポータル https://saiseiiryo.jp/
12) 日本オープンイノベーション大賞 https://www8.cao.go.jp/cstp/openinnovation/prize/index.html
13) 欧米で市販されている幹細胞等を利用した医療製品(SKIP)
https://skip.stemcellinformatics.org/knowledge/worldprod/products/
14) 第411回中央社会保険医療協議会総会 2019年3月27日(厚生労働省)
15) 第154回中央社会保険医療協議会薬価専門部会 関係業界からの意見徴収について(薬-5)「再生医療等製品の価格算定に対する意見」2019年7月24日(厚生労働省)


