- PDF:PDF版をダウンロード
- DOI: https://doi.org/10.15108/stih.00282
- 公開日: 2022.03.22
- 著者: 黒田 玄、矢口 雅英
- 雑誌情報: STI Horizon, Vol.8, No.1
- 発行者: 文部科学省科学技術・学術政策研究所 (NISTEP)
ナイスステップな研究者から見た変化の新潮流
京都大学大学院薬学研究科
准教授 樋口 ゆり子 氏インタビュー
細胞膜修飾による細胞機能の制御
-細胞を用いた新しいドラッグデリバリーシステムの開発-
第2研究グループ 研究員 矢口 雅英
「ナイスステップな研究者2021」に選定された樋口ゆり子氏は、薬の治療効果を生体内の必要な場所で必要な期間だけ発揮させるドラッグデリバリーシステムを開発してきた。最近は、細胞を治療薬として捉え、細胞膜の表面分子を人工的に修飾することにより、細胞の人工配置法の開発に成功し、治療細胞の体内動態を制御するほか、細胞を思い通りに配置し、マッピングできる技術を開発した。このマッピング技術を今後更に発展させ、細胞配置の多層化や、人工物への細胞配置によるバイオセンサー等の開発に取り組んでいる。
本インタビューでは、細胞膜表面修飾技術開発の着想を得られた研究や、京都大学での研究生活、薬学研究を医療へ実用化するための課題、今後の研究の展望などについて伺った。

1.「 ナイスステップな研究者2021」に選定された研究の概要
- 細胞膜表面修飾技術を用いたドラッグデリバリーシステム(DDS)開発について
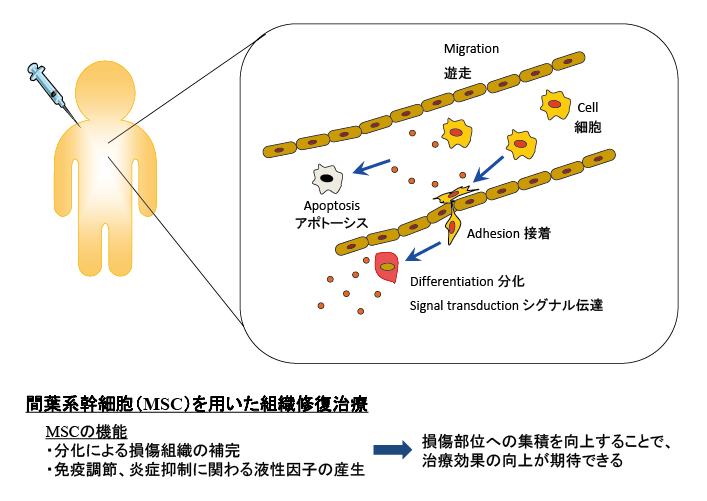
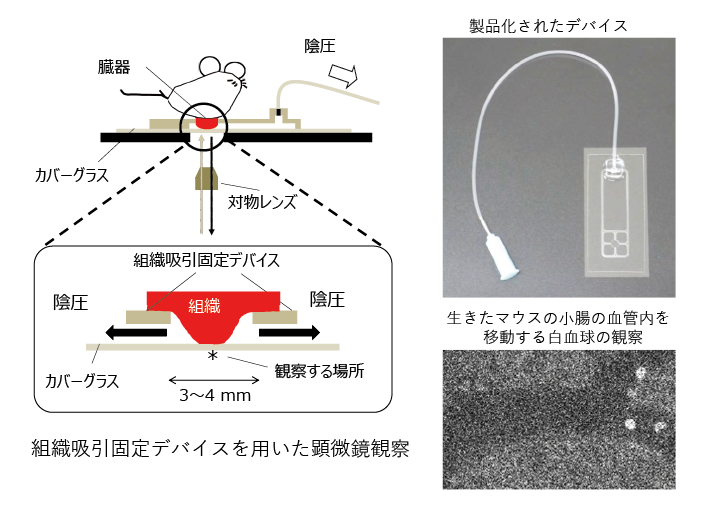
日本では、2015年に心臓に貼り付けて治療を行うシート状に培養した細胞や点滴で静脈内に投与する間葉系幹細胞が医薬品として承認され、現在まで約10種類の細胞を使った医薬品が承認されています。しかし、課題は残されており、例えば、体内に投与した細胞は治療標的だけでなく全身に広がってしまうなど、効果的な治療のための工夫が必要と考えます。私の研究室では、治療薬となる生きた細胞を体内の目的の場所に確実にデリバリーすることを目指して研究を進めています(図表1)。具体的には、損傷した臓器や組織にだけ結合する分子を細胞表面に修飾し、この細胞を標的に送達して組織修復治療を行う研究です1)。標的治療により、治療効果を向上させ、少ない細胞数で効率よく治療ができるようになります。さらに、細胞動態を可視化するため、ライブイメージングによる細胞や機能を評価するためのツール開発2、3)も合わせて行っています(図表2)。細胞膜表面修飾技術は、生体にはない反応性の官能基等を細胞の表面に付けることもできるので、デリバリー以外に利用できる可能性についても検討を始めているところです。
近年、3D細胞培養が注目されています。そのような方法で作製された組織片は、医薬品開発において候補の化合物から薬になり得るものを選出するときの動物実験に替わる評価方法や、患者さんから採取した細胞で作った組織片で治療効果を確認することで個人の特性にあった治療薬を選出する方法として利用することが期待されています。例えば、がん細胞、血管内皮細胞、線維芽細胞など複数の種類の細胞を混ぜると、がん組織のような組織片ができて、その中に血管内皮細胞が血管を作ります。その組織片の血管に薬を流して、抗がん剤の治療効果をスクリーニングすることができます。生体内のがん組織の血管が再現できたことは画期的ですが、自然に任せた組織形成のため、血管の分岐や太さのコントロールができません。血管の形状の違いで血液の流れ方が変わり、それが治療効果の結果に影響するため、血管形成のコントロールが次の課題となります。
そこで、細胞の表面を修飾する技術を展開して、細胞の人工配置の研究に着手しました。例えば、抗体と抗原の組合せや、特異的に結合する官能基の組合せを利用して、細胞を固定したい場所と細胞の表面に、ペアとなるそれぞれの分子や官能基を修飾しておけば、特定の場所に特定の細胞を接着させることができて、平面上に思い通りに細胞を配置できます。様々な色の砂を思い通りに貼り付けていくと、絵ができあがる砂絵のようなイメージです。そのようにして、細胞をブロック玩具のように積み上げれば、枝分かれや太さのそろった血管を持つ細胞ブロックになり、薬のスクリーニングがより精密にできるようになります。COI2021会議注1では、「細胞の人工配置法の開発」というテーマで、砂絵を用いて説明し、JST理事長賞を受賞しました。現在、一層目は成功し、一層目と二層目の間のリンカーを開発しています(図表3)。密度をコントロールするのが難しくて、どうやったら細胞を隙間なく奇麗に並べられるかが今の課題です。将来的に多層化していくことができれば、思い通りに細胞をマッピングした3D培養や組織片の作製につながります。また、細胞の表面修飾技術を利用して、ガラスや金属のセンサーなどの人工物に細胞を配置できるので、更にもっと面白い「新しいかたちの薬」を作りたいと考えています。
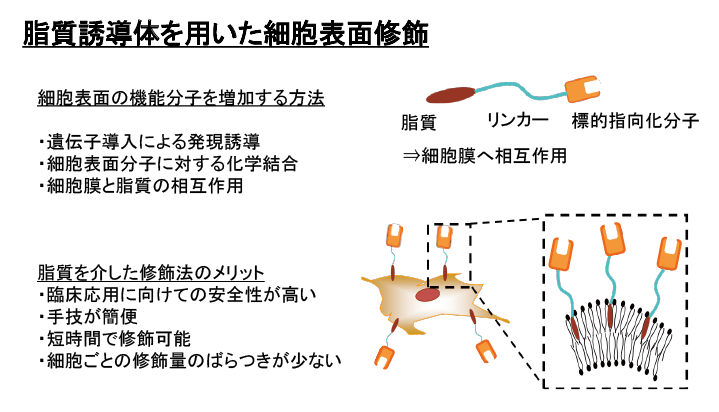
2. 研究生活
- 京都大学の魅力
京都大学(以下、京大)薬学部4年生のときに配属されてから、就職後も同じラボで研究してきましたので、外の空気が吸いたくて、新しく始めたイメージング研究のテーマで「さきがけ」注2に応募し、採択されました。そこでは、薬学以外の研究に携わり、留学や大きなプロジェクトの運営など様々な経験と引き出しを持った研究者と知り合うことができて、とても刺激を受けました。京大は自由な学風が魅力で、自由に考えて動くことが推奨されており、異分野の研究者と連携したい人にとっては、とても居心地がいいと思います。同じ研究室にいながら、DDSから始まり、イメージング、細胞の固定など、多方面に自由に研究を展開している私のスタイルは、京大の自由な校風で育てられたものだろうと思います。
- 薬学部の魅力
薬学部の魅力は、化学・生物・物理・医療、幅広い分野の研究者が集まっていて、それぞれ研究のバックグラウンドが多様なところです。学部教育のときに基礎科目を幅広く勉強するので、異分野融合の素地があって、後々に異なる分野に飛び込んでいきやすいですね。
高校生のときは、薬学部は薬剤師のイメージが強く、医師には向いていないと思ったのですが、医学の研究がしたくて医学部を目指していました。医学も薬学も、人が生きている限り必要な学問だと思います。その中で、新しい薬を開発したり、検査方法を開発したり、そのために病気の原因を解明したりする研究、というのが薬学研究の特徴だと思います。自分たちが毎日生きているということに密着した「何でだろう?」が研究のテーマになるので、魅力は尽きません。生体機能や物質が生体に及ぼす影響のメカニズムを深く知る科目が薬学には多いので、「何でだろう?」とメカニズムに近いところに興味がある人は薬学部に向いていると思います。
- 研究者になられたきっかけ
大学に入る前は、大学で研究に携われたらいいなくらいで、研究を職業にするとは思っていませんでした。家族や親戚は文系で、大学院修士課程に行くときにも家族から「まだ2年も行くの?」と言われるような環境で研究者が身近ではなかったからかも知れません。博士課程への進学を決めるときは、修士では研究をやり切った感がなかったので、博士課程を出てから就職してもいいなと思い、進学しました。博士に行くと就職が難しく、博士進学を決めるときに、将来の進路をアカデミアか企業かを決めないといけない学部もある中で、幸いにも薬学は、当時から博士課程を出てから就職できましたので、研究をやり切って納得してから就職しよう、と博士の進学を決断しました。
私が所属した研究室では、製薬企業の方の話を聞く機会が多く、その中で、博士課程2年のときに、ゴールがはっきりしている製薬企業よりも、分野を超えて「何でだろう?」を自由に研究できるアカデミアの方が私には向いていると気づき、そのとき初めてアカデミアで研究者になることを意識しました。京大の中で薬学部は、入学時の女子学生は多い方ですが、博士進学、アカデミアに進む女性は多くありません。学会などで他大学の先生や同年代の人から話を聞いたり、研究室の先輩たちの研究する姿を見て、研究者になる決心がつきました。今、進学や進路を迷っている学生さんは、是非研究室や学会でいろいろな方の話を聞いてみてください。
- 細胞膜表面修飾技術開発の着想を得られた原点となる研究
DDSとの出会いは、配属前の研究室見学で橋田充教授の話を聞いたときです。人の体の中に入ったもの(薬)の動きを人工的に制御できるDDSに魅了されました。橋田教授の研究室に入り、リポソームという脂質膜からなる微粒子の表面に標的指向化分子を付け、遺伝子などを薬としてデリバリーする研究を行いました。この技術を細胞に応用できたら、細胞の体内動態も制御できるのではないか、と考えました。
リポソームも細胞膜も、脂質で構成される膜です。リポソームの脂質微粒子を形成させてから、超音波や有機溶媒などを利用して、脂質と標的指向化分子の結合体を差し込むことでリポソーム膜に標的指向化分子を修飾する方法があります。リポソームの直径は約100nm、細胞の方は10μmで、大きさは違いますが、細胞も同じ脂質膜で覆われているので、リポソームと同じように細胞膜にも分子を修飾できるのでは、と思ったのが原点です。
細胞の膜を修飾してデリバリーする細胞治療薬の研究を始めたころに、iPS細胞研究が盛んになり、なぜiPS細胞を使わないのかとよく聞かれましたが、「細胞膜は一緒やん。どんな細胞にも使えるものが面白い。」と考えていました。膜の形状や構造は共通していますので、iPS細胞やCAR-T Cellにも私の技術は使えます。すぐ近くにiPS研究所も医学部もありますので、細胞のデリバリーや貼り付ける技術が確立したら、興味を持ってくれる方を探して一緒に研究したいですね。

- 研究環境について
京大は、研究環境に恵まれていると思います。一方で、これはどこの大学も同じかも知れませんが、研究や教育関係以外の業務(委員会や会議、評価報告など)も多く、若い優秀な研究者がもっと研究に専念できればいいのにと思うケースもあります。最近、京大では、総長の意向により、学内のシステムを熟知した人材を育成して各学部に配置することで、先生方の事務的な負担を軽減する方針が進められていると聞いています。国によって事情は異なるので比較は難しいのですが、世界との競争に負けないために、日本の大学で研究者が研究にもっと専念できる環境が整うことを切に願います。
3. 薬学研究の医療への実用化
- in vitro(生体外)とin vivo(生体内)の違いについて
in vitroとin vivoは全然違います。血液、血流の有無が一番の原因です。血液の流れが細胞への取り込みに影響するだけではなく、血液には血清タンパク質や血球細胞が含まれていて、薬と相互作用するので、細胞培養液とは薬がおかれる環境が全く異なるのです。その結果、培養細胞で薬を特定の細胞へ取り込ませることに成功しても、生体に投与すると、血中のタンパク質と結合したり、マクロファージなどの目的細胞以外の細胞に取り込まれたりしてしまうため、思ったとおりにいかないことが多いのです。
治療効果の面では、細胞や抗体を使った治療研究のゴールはヒトを治療することですが、ヒトでは実験できないため最初はマウスで研究を行います。細胞や抗体などのバイオ製剤は、種差(ヒトとマウスなど)が治療効果に及ぼす影響が大きく、in vitroではヒト由来の細胞で実験できますが、in vivoでは最初はヒトで実験できないので、免疫の拒否反応が起きないようヌードマウスや免疫不全マウスを用います。このようにバイオ製剤の研究は、治療効果の実験デザインでin vitroとin vivoの苦労が随分異なります。
- 基礎研究を臨床研究に応用させていく秘訣
治験を行うには、申請などの手続きのプロが必要です。医師主導の治験では、興味を持ってくれる医師の協力が不可欠です。基礎研究を臨床研究に応用するための障壁は、そのような専門家との出会いが身近にあるかどうか、にあると思います。
京大では、メディカルイノベーション大学院プログラム(MIP)で、薬学部と医学部の博士人材育成のプログラムがあり、さらに、医薬系研究交流サロンという研究発表で研究交流できる機会があります。比較的、附属病院と近い関係にある点からも、恵まれていると思います。特許出願も含めて、臨床研究に応用する場合は、基礎研究の段階から先を見据えて準備をすることと、専門家のサポートが必要だと思います。
- 研究を進めていく中で感じる日本の政策的課題
創薬研究では、医学や薬学だけでなく、工学部の中にも医工学という分野もあるので、学部を問わず、研究者が交流できる場を増やしてほしいと思います。実用化に向けては、ベンチャーや企業の実用化のプロの助言、持っているデータや技術の広報やマネジメントなどが必要と思います。更に進んで、企業と共同研究をする場合は、秘密保持や情報公開など、企業側、アカデミア側の事情をよく理解してコーディネートしてくれる専門家の支援があるととても助かります。京都大学大学院医学研究科「医学領域」産学連携推進機構(KUMBL)注3や京都大学大学院医学研究科メディカルイノベーションセンター(MIC)注4は、医学領域の企業との1対1のプロジェクトのマネジメントをサポートする部署で、研究のことをよく理解されている博士の学位を持つスタッフがサポートしてくださるのでとても助かっています。
- 博士人材の育成について
博士課程修了後のキャリアパスに不安を感じて博士課程への進学を躊躇してしまうことが、課題だと思っています。製薬企業は、これまでも博士課程修了後の学生の採用は少なくないと思いますが、今後日本の多くの分野において博士課程を修了した学生の採用が増えてほしいと思います。博士課程では、専門分野の知識や技術を習得するだけでなく、研究を通して課題解決のための能力やプレゼン能力も身につきます。社会でもそのような能力が必要な場面が多いのではないでしょうか。対象とする課題が変わっても、身につけた能力を発揮して社会に還元できることは多いと思います。
実際、薬学部の修士を卒業後、製薬企業に就職して数年後に博士の学位の必要性を感じて学位を取りたいと思う卒業生は多いようです。社会人を経験してから博士の学位を取得する制度はありますし、そのような意思を持った人に学位取得の機会があることはすばらしいと思います。しかし、勤務先での仕事と研究テーマが近い、勤務先の業務と研究に割く時間のバランスなど、勤務先の理解と環境や条件がそろわないと難しいケースが多々あります。実験のほかにも、実験デザインのための情報収集、実験デザインの構築、得られた結果のディスカッションに十分な時間が割けないと、大学院で学ぶ意味がありません。社会に出た人が大学院に戻って学ぶ、大学院に進学した人が途中で進路を変更して社会に出る、どちらも人生の選択として受け入れられ、社会の理解が得られるようになってほしいと思います。
4. 今後の研究の展望
- DDSや細胞治療の発展性について
DDSは薬がある限り必要な技術で、進化していくものだと思います。これまで、薬の主体が低分子の化合物、タンパク質、遺伝子、細胞と、形態・形状が大きく変化し、それに伴ってそれぞれに対して適切かつ効果的なDDS技術が進化してきました。今後、デジタルメディスン注5など、更に薬の主体が進化すると、その薬の機能を効率よく発揮させるために、どうやって生体の中の分布や機能を制御するかの戦略が新たに必要になります。それがDDSの面白いところです。
臨床では、細胞が治療に使われるようになってきたばかりで、まだまだ工夫が必要です。治療したい組織に細胞を送達することで、今よりも少ない細胞数で効率よく機能させたり、特定の場所で治療効果を発揮させたりするようなDDSの開発を進めています。臓器を丸ごと入れ替えるような臓器移植にかわって、シート状の細胞を貼り付ける治療が最近幾つか承認されましたが、立体化した小さな組織片を移植して機能させるような技術がホットな研究になると思います。
- 細胞膜修飾の技術でこれからどのようなことが実現できるか
機能不全に陥った組織に対して、細胞を体外から注入して、体内で組織再生を促し機能を回復させるのが、現在の私の研究目標です。細胞表面の膜修飾によって目的の場所へ接着させるところまで来ましたが、さらに、接着先でシグナルを送受信することができれば、もっと面白いことができると思います。細胞の外と中は細胞膜によって断絶されていますが、細胞膜貫通タンパクは、細胞内へシグナルを伝達する機能があります。そのようなシグナルを伝達する機能を人工的に膜に搭載できれば、未分化細胞を目的の場所に輸送して、さらに、分化させることで、組織再生につなげることができます。いわば、細胞に機能を制御するスイッチを付けるようなものです。前例がないところからアイディアを出して、まだこの世にない新しいものを創るプロセスは、AIにはできない最も楽しい部分でもあります。
5. 若手研究者へのメッセージ
京都大学ではオープンラボを積極的に実施しています。研究に興味を持つ高校生に対して、数回ラボで実験してもらい、その成果を発表するELCAS(エルキャス)というプログラムがあります。大学は、研究と教育で成り立っておりますので、次の時代のサイエンスを担っていく研究者を目指す若者に、研究の楽しさを知っていただきたいと思います。
私は小さいころから、便利なものを自分で新しくつくることが大好きでした。アイディアを実現させてお給料をいただける仕事は最高です。今はまだ生活の中で使われていなくて多くの人に知られていなくても、自分が世を去った後、これは便利だ、面白いね、誰がつくったのだろう、誰が考えたのだろう、と人々に喜ばれる、面白がってもらえる「もの」に研究成果がつながることが夢です。これこそが研究の魅力ではないかと思います。
(2022年1月5日インタビュー)

注1 2018年12月19日、日本科学未来館にて開催された第4回COI2021会議において、樋口ゆり子氏が「細胞の人工配置法の開発」でJST理事長賞を受賞した。思い通りの場所に複数種類の細胞を固定培養し、細胞を再構築する方法について、砂絵を例に用いて実演しながら説明した。
注3 京都大学大学院医学研究科「医学領域」産学連携推進機構(KUMBL) (https://www.kumbl.med.kyoto-u.ac.jp/index.php)
注4 京都大学大学院医学研究科メディカルイノベーションセンター(MIC) (http://www.mic.med.kyoto-u.ac.jp/index.php)
注5 デジタルメディスン「エビリファイ マイサイト(Abilify MyCite)」は、大塚製薬株式会社とプロテウス・デジタル・ヘルス社(本社米国)が開発した、世界初の錠剤型服薬管理システム。錠剤に極小センサーを組み込み、服用するとセンサーが胃内でシグナルを発し、患者の身体に貼り付けたシグナル検出器「マイサイトパッチ」が検出、服用データや活動データを記録し、専用の「マイサイトアプリ」に送信され、スマートフォンやモバイル端末でデータ管理ができる。成人統合失調症、双極性障害、大うつ病性障害の補助療法において使用できる。2017年米国FDA承認。
参考文献・資料
1) 樋口ゆり子「細胞膜修飾による細胞挙動の制御」薬学雑誌、141巻5号、2021年
(https://doi.org/10.1248/yakushi.20-00219-6)
2) Higuchi Y. et al. Polymaidoamine dendrimer-conjugated quantum dots for efficient labeling of primary cultured mesenchymal stem cells. Biomaterials, 32(28), 6676-6682, 2011
(https://doi.org/10.1016/j.biomaterials.2011.05.076)
3) 樋口ゆり子、保坂誠、小西聡「小動物臓器のintravital imagingのための組織固定器「イメピタ」の開発」薬剤学、78(6)、259-262、2018年(https://doi.org/10.14843/jpstj.78.259)


